Antibiogramme: Allgemeines zum Thema Resistenztestung
Durch die Etablierung von Testmethoden für die Antibiotika-Empfindlichkeit bzw. -Resistenz von Bakterien (Antibiogramme) und Pilzen (Antimykogramme) in der zweiten Hälfte des vergangenen Jahrhunderts wurde eine zielgerichtete Therapie von Infektionen erst möglich.
Die dabei zum Einsatz kommenden Verfahren erlauben eine Unterteilung in gegen die eingesetzten Test-Antibiotika empfindliche und resistente Erreger sowie die außerordentlich wichtige Überwachung der allgemeinen Resistenzsituation.
Fachgesellschaften und Prüfstandards
Aufgrund der hohen Komplexität der verschiedenen Testverfahren und der vielen Variablen, die die Ergebnisse beeinflussen (für die Testung erforderliche Antibiotikakonzentrationen, unterschiedliche Dosierungskonzepte in der klinischen Praxis, Nährbodenzusammensetzung, Bebrütungsbedingungen, Dichte der Bakterieneinsaat bei der Resistenztestung, Bewertung von Studienergebnissen aus Klinik und Labor) ist eine Methodenstandardisierung unumgänglich. Dies wird seit Jahren weltweit im Wesentlichen von zwei Institutionen übernommen:
EUCAST (European Committee on Antibiotic Susceptibility Testing), www.eucast.org
sowie
CLSI (Clinical Laboratory Standards Institute, USA), www.clsi.org
Beide Prüfstandards werden jährlich ergänzt und auf den neuesten Stand gebracht, unterscheiden sich jedoch durchaus im Hinblick auf den organisatorischen Aufbau, die zu Grunde liegenden Antibiotika-Dosierungen, Nährmedien und die Interpretation der Messwerte.
Ein für die klinische Praxis wesentlicher Unterschied liegt in der im Antibiogramm vollzogenen Interpretation der Messwerte. So hat das EUCAST 2019 einen bemerkenswerten Wechsel vollzogen, der zu einer größeren Eindeutigkeit der Befunde geführt hat, indem anstelle der bis dahin geltenden Kategorie „intermediär empfindlich“ die Kategorie „sensibel bei erhöhter Exposition“ eingeführt wurde, in der Mehrzahl der Fälle gleichbedeutend mit „sensibel bei erhöhter Dosierung“ (siehe unten).
Unser Labor arbeitet seit Jahren mit dem EUCAST-Standard. Auf die Vorgaben anderer Gesellschaften wird nur bei Fehlen anderer Alternativen zurückgegriffen. Diese Ausnahmen sind auf unserer Homepage www.labor-limbach.de/fachbereiche/infektionsdiagnostik/befundinterpretation/erreger aufgelistet.
Minimale Hemmkonzentration (MHK)
Der zentrale Begriff in der Antibiotika- (und Antimykotika-) Resistenztestung ist die Minimale Hemmkonzentration (MHK).
Bei der Resistenztestung wird eine Bakteriensuspension definierter Dichte mit unterschiedlichen Antibiotikakonzentrationen konfrontiert. Die geringste Antibiotikakonzentration, die ein sichtbares Wachstum von Bakterien in der Suspension verhindert, wird als MHK bezeichnet. Es handelt sich dabei also um einen Messwert, der die Empfindlichkeit des untersuchten Keimes gegen das Testantibiotikum kennzeichnet.
Alle gängigen Methoden der Resistenztestung beziehen sich letztendlich auf die Bestimmung der MHK.
Die Interpretation der MHK ermöglicht dem behandelnden Arzt die Wahl des am besten geeigneten Antibiotikums, insbesondere bei komplexen Infektionen in schwer erreichbaren Kompartimenten, und die individuelle Dosierung auch mittels therapeutischen Drug-Monitoring. Im Normalfall ist die Auswahl des Antibiotikums anhand der S/I/R Einteilung unter Berücksichtigung aktueller Therapieempfehlungen ausreichend.
Interpretationshilfe:
Grundsätzlich gilt: Je niedriger die MHK desto „besser“. Eine niedrige Konzentration der Substanz hemmt also schon das Bakterienwachstum. Beispiel: Einen Staphylococcus epidermidis mit einer Vancomycin MHK von 0,5 mg/l kann man besser mit Vancomycin behandeln als einen Staphylococcus epidermidis mit einer Vancomycin MHK von 2 mg/l.
Das gilt aber nur innerhalb der gleichen Substanz und ist nicht über verschieden Substanzen hinweg gültig. Jede Substanz hat ihren eigenen Konzentrationsbereich (festgelegt in EUCAST bzw. CLSI). Eine MHK von Ciprofloxacin von 1 mg/l bei Eschericha coli ergibt die Interpretation R, wohingegen eine MHK von Ceftriaxon von 1 mg/l als S Interpretation wird.
Findet sich neben einem Antibiotikum keine MHK, so ist die Interpretation von Werten für ein nahe verwandtes Antibiotikum abgeleitet oder die Testung wurde mit einer anderen Methode durchgeführt (zum Beispiel mittels Testplättchen im Agardiffusionstest). Die Substanzen können aber klinisch genauso gut eingesetzt werden, wenn Empfindlichkeit vorliegt.
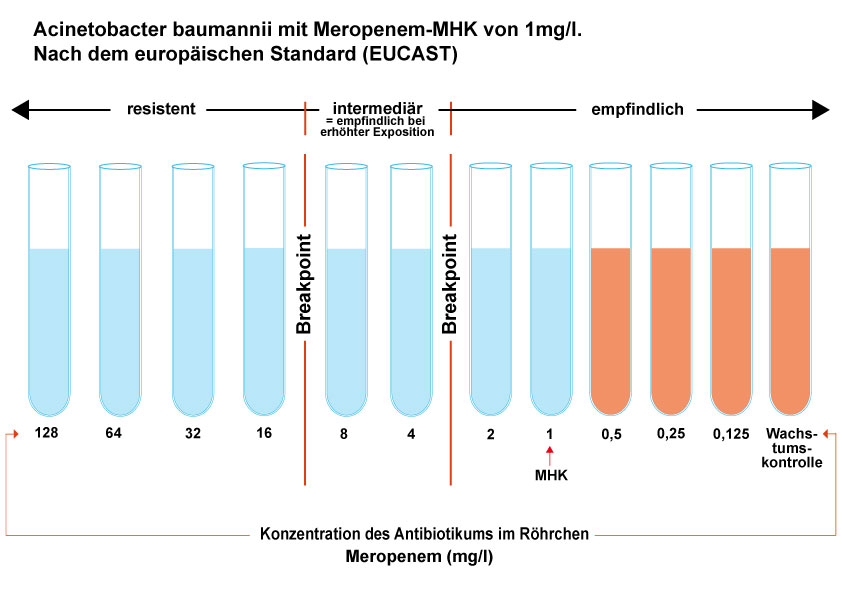
Im Bouillon-Verdünnungstest werden Nährlösungen mit absteigenden Konzentrationen des Antibiotikums hergestellt (hier Meropenem) und mit einer gleichen (niedrigen) Anzahl von Bakterien beimpft (hier Acinetobacter baumannii). Während sich die Bakterien in der Wachstumskontrolle bzw. bei niedrigen Konzentrationen des Antibiotikums vermehren und nach 24 Stunden eine Trübung verursachen, wird das Wachstum durch eine hohe Antibiotikakonzentration gehemmt. Die Bouillon bleibt klar. In unserem Beispiel ist die niedrigste Konzentration, die das Wachstum hemmt – also die MHK – 1 mg/l. Interpretiert nach EUCAST 2021 ergibt das S.
Interpretation der MHK-Werte – das Antibiogramm
Das neue „I“ (EUCAST)
Um die klinische Wirksamkeit des Antibiotikums abzuschätzen, wird die MHK in Beziehung gesetzt zu den durch die Fachgesellschaft festgelegten Grenzwerten (Breakpoints). Auf der Basis dieses Abgleiches wird der getestete Keim nun im Antibiogramm als sensibel (S), sensibel bei erhöhter Exposition (I) oder resistent (R) gegen das Testmedikament bewertet (EUCAST).
Im amerikanischen Standard CLSI existiert die Bewertung sensibel bei erhöhter Exposition nicht – stattdessen wird noch mit dem Begriff intermediär empfindlich (unglücklicherweise ebenfalls mit I abgekürzt) gearbeitet, der nicht gleichgesetzt werden darf mit dem EUCAST-I.
Substanzen, die mit der EUCAST-Bewertung I bewertet wurden, können bei adäquater Dosierung völlig gleichwertig eingesetzt werden mit den Medikamenten, die mit „S“ bewertet wurden. Mit anderen Worten: Die mit „S“ gekennzeichneten Antibiotika sind nicht automatisch als wirksamer zu bewerten als die mit „I“ bewerteten. Die Kenntnis dieser Umstände spielt eine besondere Rolle in der Beurteilung von Pseudomonas-Antibiogrammen, da hier nur noch für Meropenem und die Aminoglykoside „S“-Breakpoints vorliegen. Für die anderen im Antibiogramm angeführten Antibiotika gilt bei Pseudomonas-Infektionen auch bei maximaler Empfindlichkeit die Empfehlung einer Hochdosis-Therapie – es erfolgt also eine Bewertung mit “I“ (sensibel bei erhöhter Exposition, Beispiel: 4 x 4,5 g Piperacillin/Tazobactam statt 3 x 4,5 g).
Definition des Begriffes Exposition (EUCAST): Mit Exposition wird der Wirkspiegel eines Antibiotikums bezeichnet, mit dem die ursächlichen Erreger vor Ort im infizierten Gewebe konfrontiert sind.
Eine erhöhte Exposition wird in aller Regel durch eine erhöhte Antibiotika-Dosierung erreicht – bei Infektionen in Kompartimenten mit einer natürlichen Anreicherung der zum Einsatz kommenden Medikamente kann allerdings auch die Standarddosis ausreichen, um dieses Ziel zu erreichen (Beispiel: Einsatz von Betalaktam-Antibiotika bei Harnwegsinfektionen in Standarddosis, da eine Anreicherung über die Niere erfolgt, die zu einer erhöhten Exposition in den ableitenden Harnwegen führt).
Fallspezifische Antibiotika-Auswahl
Wenn mehrere Antibiotika mit dem Testergebnis S (oder I) gekennzeichnet sind, bedeutet das nicht, dass man in jedem Fall von einer gleichwertigen Wirksamkeit dieser Medikamente ausgehen kann. Es bedeutet vielmehr, dass der behandelnde Arzt/die behandelnde Ärztin sich aus den mit S bzw. I bewerteten Substanzen diejenige aussuchen sollte, die bei dem zu behandelnden Krankheitsbild und den gegebenen Anforderungen an Pharmakokinetik und Pharmakodynamik am Besten passen.
In Zweifelsfällen können diese Fragen mit dem lokalen ABS-Team bzw. den betreuenden Mikrobiolog*innen geklärt werden.
Sonderfall Tuberkulose- und Mykobakteriosediagnostik
Für die Resistenztestung von Tuberkulose-Erregern / Mykobakterien gibt es keine von der EUCAST empfohlenen Verfahren und Bewertungen. Die derzeit verwendeten Verfahren und Konzentrationen basieren auf Expertenwissen und wurden durch internationale Absprachen festgelegt. Für die Tuberkulose wurden die Vorgaben letztendlich durch die WHO bestätigt. Sie sind auch in einer CLSI-Norm übernommen.
Ebenfalls anders als oben beschrieben, wird die Resistenzprüfung von Tuberkulosebakterien nicht als MHK-Bestimmung, sondern als Testung bei einer einzigen Konzentration eines Antibiotikums durchgeführt (sog. „kritische Konzentration“). Wachstum bei dieser Konzentration bedeutet Resistenz gegenüber diesem Antibiotikum („R“). Kein Wachstum im Antibiotika-haltigen Medium bei gültigen Wachstumskontrollen zeigt die Empfindlichkeit des Stammes gegenüber dem Antibiotikum an („S“). Die Einschätzung „I“ wird für die Bewertung der Empfindlichkeitsprüfung von Tuberkulosebakterien nicht verwendet.
Die Testung von nicht-tuberkulösen Mykobakterien (NTM) basiert weitgehend auf Expertenwissen und darauf beruhenden Verfahren. Ein CLSI-Standard gibt Empfehlungen zu einer MHK-Testung ausgewählter Antibiotika bei bestimmten NTM-Spezies, wobei hier die Kategorisierung „I“ für intermediär weiterhin verwendet wird.